|
ỨC CHẾ CHỐT KIỂM SOÁT MIỄN DỊCH
Immune
Checkpoint Inhibitors
Trần Minh Quân tổng hợp và chuyển ngữ
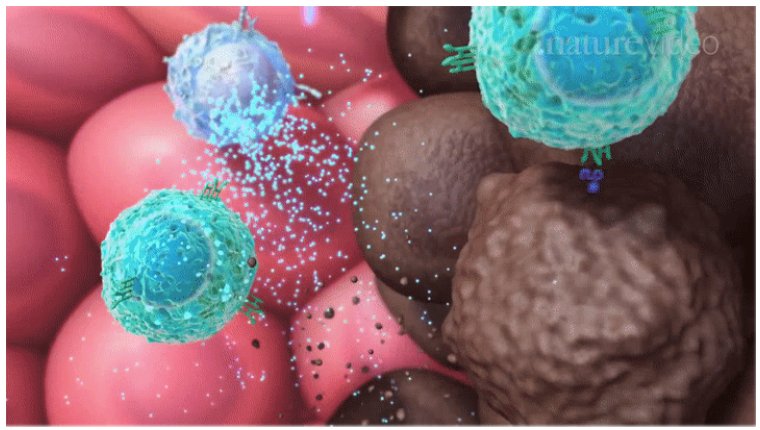
Tumour immunology and immunotherapy
Trần Minh Quân
nhận được một tài liệu do một vị Thân hữu đàn anh
chuyển đến, tài liệu về “Checkpoint Inhibitor” từ Survivornet.com cùng
lúc với tin không vui về một người bạn đang ‘được’
dùng phương pháp trị liệu này..TMQ xin tổng hợp các
tài liệu về đề tài này từ National Cancer Institute,
Thư viện Y Khoa Quốc gia Mỹ PubMed..
Những danh
từ y-dược trong các tài liệu rất khó chuyển ngữ, TMQ
không thuộc giới chuyên môn, nên xin dùng các danh
từ tiếng Việt (trong nước) của BS Phạm Nguyên Tường
và ghi lại nguyên văn một số danh từ chuyên môn.
Các phương pháp
chính để điều trị ung thư hiện nay gồm :
* Hóa trị
(chemotherapy)
* Phẫu thuật (surgery)
* Xạ trị
(radiotherapy)
* Liệu pháp miễn dịch
(immunotherapy), là liệu pháp mới (từ 2001).
Cancer immunotherapy
hay immuno-oncology, là phương pháp điều trị ung thư
dựa vào hệ thống miễn nhiễm của cơ thể để chống lại
bệnh ung thư. Phương pháp giúp hệ miễn nhiễm tìm và
diệt tế bào ung thư bằng kích khởi hoạt động hay
biến đổi phương thức hành động của hệ miễn nhiễm.
Liệu pháp miễn dịch là một loại trị liệu sinh học,
dùng các hoạt chất, lấy từ cơ thể sinh vật sống để
trị bệnh. Có nhiều loại immunotherapy như dùng:
* Thuốc Ức chế Chốt
kiểm soát miễn dịch, thuốc chặn các chốt miễn dịch
đang có bình thường của hệ miễn nhiễm) (chủ
đề của bài này).
* Thuốc chủng chống
ung thư (Cancer vaccines).
* Chuyển tế bào ‘nuôi
dưỡng’ = Adoptive cell transfer.
* Dùng các siêu vi
trùng gây nhiễm tế bào ung thư (Tumor-infecting
viruses).
* Cytokines.
* Trị liệu dùng genes
(Gene therapies).
Immunotherapy có
thể được dùng để trị nhiều loại ung thư bao gồm ung
thư óc, vú, cổ tử cung, ruột già, thực quản, đầu-cổ,
leukemia, gan, phổi, hạch (lymphoma), da, bao tử ..
Immunotherapy
có thể được dùng phối hợp với các phương pháp trị
liệu ung thư khác..
Hình: Immunotherapy
* Định nghĩa
căn bản (dựa theo Cleveland
Clinic).
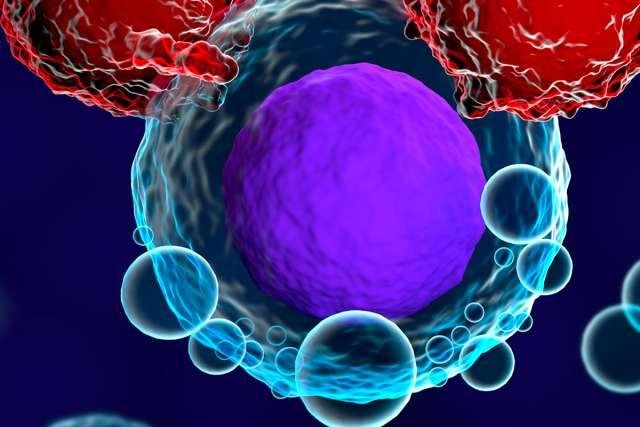
Để chống ung thư, Hệ thống miễn nhiễm tùy
thuộc vào các T-cell (của cơ thể).
Hình: T-cell
T-cell là một loại bạch cầu, còn có
tên là tế bào lympho (lymphocytes).
T-cell giúp Hệ thống miễn nhiễm của cơ thể chống lại
các vi sinh vật gây bệnh (siêu vi trùng, vi khuẩn,
nấm gây bệnh và ký sinh trùng); bảo vệ cơ thể chống
bệnh. Lymphocytes bao gồm các T-cell và B-cell
(B-cell sản xuất các kháng thể = antibodies) và
Regulatory (suppressor) T cell.
Có 2 loại T-cell chính:
* Cytotoxic
T-cell, gắn vào kháng nguyên có trên các tế
bào bất bình thường, tiêu diệt các tế bào bị nhiễm
siêu vi khuẩn, vi trùng và cả tế bào ung thư, còn có
tên là Tế bào CD8+ vì có mang các
thụ thể CD8 trên màng tế bào.
* Helper T
cells hay CD4+ vì màng tế
bào có những thụ thể CD4, tuy không trực tiếp diệt
các tế bào khác nhưng gửi các tín hiệu hướng dẫn các
tế bào miễn dịch khác chống lại sự gây nhiễm bệnh.
Helper T cell báo hiệu cho cytotoxic T-cell, B-cell
và tế bào macrophage (thực bào).
Tuy không được xem
là một T-cell chính nhưng Regulatory T
cell (suppressor cells) cũng có những vai trò quan
trọng khác trong Hệ miễn nhiễm. Các ‘suppressor
cell’ này giúp giảm bớt hoạt động của T-cells khác
khi cần thiết, có thể ngăn chặn-cell không cho tấn
công các tế bào lành mạnh trong cơ thể. T cell là
những tế bào chuyên biệt rất mạnh và có tiềm năng
gây hại cho các tế bào lành mạnh. Trên màng tế bào
T-cell có những protein có khả năng mở =
‘turn on’ một đáp ứng miễn nhiễm (như khi
nhiễm bệnh) và cũng có những protein đóng =
‘turn off’ hoạt động này lại. Các protein
này được gọi là protein ‘chốt kiểm soát miễn dịch’.
Có những checkpoint
protein kích khởi T-cell hoạt động, trở thành active
(như khi bị nhiễm bệnh) nhưng nếu T-cell bị ở vào
trạng thái hoạt động quá lâu hay khi phản ứng lạc ra
ngoài phạm vi, T-cell có thể phá hủy các tế bào lành
mạnh. Do đó Cơ thể cần có các checkpoints khác để
đóng chốt và khóa các T-cell ‘lôi thôi’ lại.
Một số tế bào ung
thư và tế bào T-cell sản xuất ra rất nhiều protein
nên có thể ‘khóa’ hoạt động T-cell không để T-cell
làm nhiệm vụ cần thiết là tấn công tế bào ung thư!
Chốt kiểm
soát miễn dịch được Tiến sĩ Jim Allison Ph.D khám
phá vào năm 1996. Ông Allison nhận thấy các T-cell
được kiểm soát bởi một cơ chế, ông gọi là ‘cái thắng
= phanh’ (brake). Cơ chế này là một protein loại
chốt, tiêu cực (negative), Ông đặt tên là CTLA-4. Protein
‘chốt’ này đã ‘khóa’ T-cell lại và ngăn cản T-cell
không cho gây hại các tế bào lành mạnh.
Khi thử trong phòng
thí nghiệm, bằng cách cản (ức chế) CTLA-4, Allison
đã để riêng cho T-cell tiếp tục hoạt động và tiêu
diệt được các tế bào ung thư.
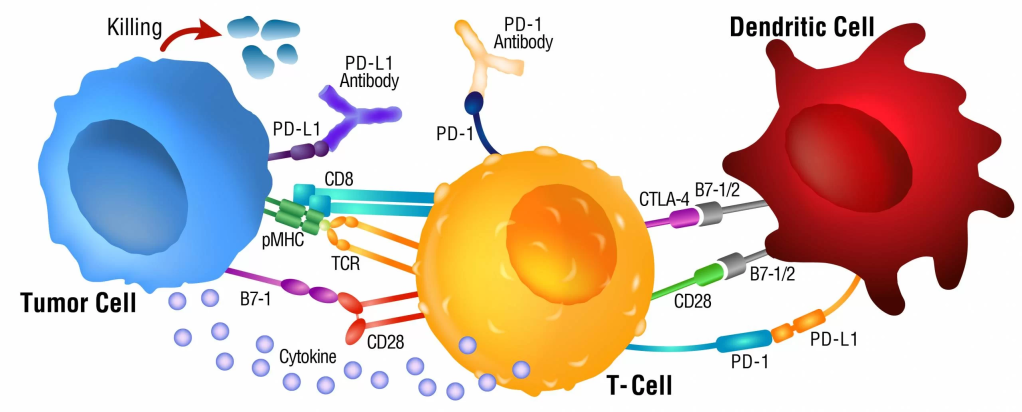
ICIs là
những thuốc điều trị ung thư theo phương pháp dùng
miễn nhiễm, có tác dụng kích khởi đáp ứng miễn nhiễm
của cơ thể, bằng cách tấn công vào mục tiêu chuyên
biệt, là các thụ thể miễn nhiễm trên bề mặt của các
T-lymphocytes. ICIs được xem là một liệu pháp trị
ung thư mới khi FDA Mỹ chuẩn thuận cho phép dùng
ipilimumab (2011).
Ngoài các kháng
thể tấn công vào 3 thụ thể chốt miễn nhiễm như CTLA-4,
PD-1 và PD-L đã được dùng trong thập kỷ qua, còn có
các thuốc loại có phân tử nhỏ và thuốc kháng thể
khác, nhắm vào các mục tiêu là những protein
checkpoint khác cũng đang được nghiên cứu như B7H3,
CD39, CD73, thụ thể adenosine A2A và CD47..
Nghiên cứu của
Allison đưa đến việc phát triển và chế tạo được ICI
đầu tiên ipilimumab có tác động
chặn protein CTLA-4. Khi block
CTLA-4, T-cell vẫn hoạt động để diệt tế bào ung thư.
Ipilimumab đã giúp kéo dài thời gian sinh tồn cho
các bệnh nhân bị melanoma ở các giai đoạn phát triển.
Một protein
negative immune checkpoint thứ nhì PD-1 được
khám phá vào năm 2000. Hai thuốc ICIs pembrolizumab
và nivolumab là những ICI chặn PD-1. Các thuốc này
được dùng trị các trường hợp ung thư nặng như ung
thư bàng quang, ung thư vú, ung thư đầu và cổ,
Hodgkin lymphoma, ung thư thận, melanoma và ung thư
phổi loại non-small cell.
ICI loại thứ ba,
chặn PD-L1; là một ICI kích khởi
checkpoint thứ nhì PD-1. Ba thuốc atezolizumab ,
avelumab và durvalimab trong nhóm này cũng đã được
dùng trong các trường hợp ung thư bàng quang, ung
thư vú, Merkel cell carcinoma (một loại ung thư da)
và ung thư phổi loại non-small cell.
Danh
sách các ICIs và các chỉ định trị liệu (Current
Oncology 24-4-2022)
A- Các thuốc
ức chế PD-1
https://pmc.ncbi.nlm.nih.gov/articles/PMC7490077/
PD-1 =
Programmed cell death protein, là một protein ức chế
thụ thể ở giai đoạn đáp ứng miễn nhiễm, khám phá vào
năm 1990s, PD-1 là một thành viên của đại gia đình
immunoglobulin (Ig) CD28/CTLA-4).
Thuốc
ức chế PD-1 (PD = Programmed Death) là loại thuốc
block hoạt động của PD-1, một checkpoint protein có
trên bề mặt của T-cells. PD-1 tác động như một nút
tắt (off-switch), để ngăn ngừa-cell tấn
công các tế bào khác trong cơ thể. Thuốc ức chế PD-1
kết bám vào PD-1 và khóa hoạt động tương tác của
PD-1 với PD-L1 (là một protein khác có trên bề mặt
của một số tế bào bình thường và tế bào ung thư). Sự
khóa chốt này sẽ cho phép Hệ thống miễn nhiễm tìm và
diệt các tế bào ung thư.
Thuốc PD-1
inhibitors, có thể có tác dụng trị liệu trong một số
trường hợp ung thư (xem bảng trên). Các thuốc được
FDA chấp thuận và chỉ định trị liệu cũng được ghi
trong bảng.
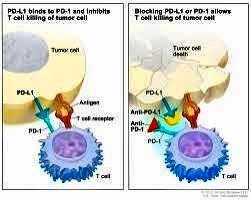
Hình: cơ chế hoạt động của thuốc ức
chế PD-1
Thuốc ức chế
PD-1 đầu tiên, được FDA chuẩn thuận cho phép thử
nghiệm điều trị (10-2014) là pembrolizumab (Keytruda@,
Công ty Merck). Thuốc được dùng dưới dạng tiêm
truyền từng giọt, theo chu kỳ mỗi 3-6 tuần, Một
chu kỳ điều trị kéo dài khoảng 30 phút. Thời
gian điều trị thường kéo dài đến 2 năm..
Giá thuốc theo
Công ty Merck, nhà sản xuất Keytruda, mỗi liều
khi điều trị cách 3 tuần là 11,564 USD; còn liều
điều trị mỗi 6 tuần giá 23,138USD.
Nivolumab (Opdivo@;
Bristol-Myer -Squibb) cũng được FDA chuẩn
thuận cho sử dụng năm 2014 là thuốc thứ 2
được FDA cho sử dụng để trị mesothelioma,
đồng thời là thuốc ICIs đầu tiên được dùng
trị ung thư bao tử. Thuốc cũng dùng chích
tĩnh mạch, mỗi 2-3 tuần. Chi phí cho chu kỳ
trị liệu là 7431 USD và 3 chu kỳ sẽ lên đến
22,293 USD.
Cemiplimab (Libtayo@;
Regeneron/Sanofi), tiêm truyền từng giọt,
mỗi 3 tuần. Thời gian trị liệu kéo dài 2
năm. nếu bệnh nhân đáp ứng tốt với thuốc.
Giá thuốc mỗi 3 tuần trị liệu là 9100 USD.
B- Các
thuốc ức chế PD-L1 PD-L1 hay Programmed
Death-Ligand 1 là một protein kiểm soát đáp
ứng miễn nhiễm của cơ thể. PD-L1 hiện diện ở
bề mặt của nhiều tế bào cơ thể, bao gồm vài
tế bào lành mạnh và tế bào ung thư. PD-L1
hoạt động như một cái thắng = phanh dùng
ngăn không cho T-cell tấn công các tế bào
lành mạnh.
Khi PD-L1
kết bám vào PD-1 (cả hai đều là những
protein có trên bề mặt T-cell) sẽ ngăn cản
T-cell tấn công các tế bào bình thường; Tuy
nhiên một số tế bào ung thư lại có nồng độ
cao PD-L1, nên chúng vẫn tránh được tác động
của hệ miễn nhiệm và có thể sinh tồn.
Thuốc ICIs
là thuốc chống ung thư, hoạt động bằng cách
bám vào PD-L1 và ngăn chúng bám vào PD-1..
Thử nghiệm
đo mức độ PD-L1, có thể giúp hướng dẫn điều
trị một số bệnh ung thư. Mức PD-L1 là một
trong số các dấu hiệu sinh học (biomarkers)
khi trị ung thư phổi.
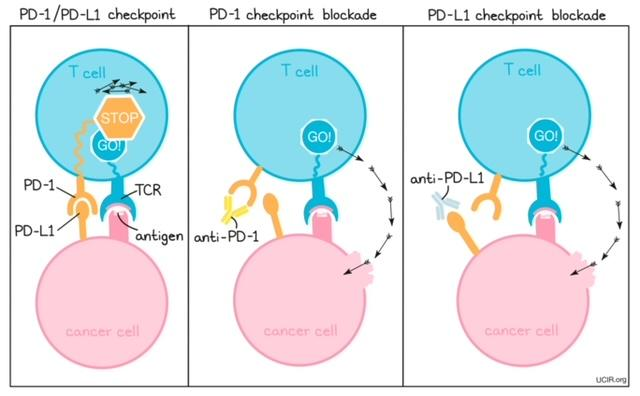
Hình: Cơ chế hoạt động của các thuốc ức chế PD-L1
PD-L1 còn có những
vai trò khác trong các diễn tiến sinh học như:
* Phát triển và Tái
tạo mô tế bào: PD-L1 có ở tế bào gốc vú (breast stem
cell), giúp phát triển các hạch vú..
* Có thai: PD-L1 trong
nhau (thai tòa) giúp hệ thống miễn nhiễm của người
mẹ dung nạp bào thai.
* Lão hóa: Các tế bào PD-L1+ lão
hóa, tích tụ theo tuổi già, chặn các tín hiệu của
PD-L1 (nên không giúp loại bỏ các tế bào đã lão hóa).
Các thuốc trên
thị trường:
* Atezolizumab (MPDL3280; Tecentriq@,Genenteh
Inc.) là một kháng thể đơn dòng (monoclonal) IgG1,
cản T-cell depletion expressing PS-L. FDA
chuẩn thuận 3/2019 Atezolizumab bám vào protein
PD-L1, (PD-L1 cần để tế bào miễn nhiễm tấn công tế
bào ung thư (nên khi ức chế PD-L1, tế bào miễn
nhiễm có khả năng tấn công các tế bào ung thư.
Atezolizumab có thể dùng đơn độc hay dùng phối hợp
với trị liệu bằng hóa chất = chemotherapy. Thuốc được
chích dưới da.. https://www.ncbi.nlm.nih.gov/books/NBK567758/
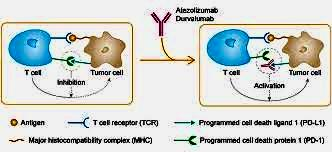
Hình: Tecentriq
* Avelumab (MSB0010718C, Bavencio@, Merck-Pfizer), cũng
là một human IgG1 monoclonal antibody, kết bám
vào PD-L1, dùng trị các trường hợp renal cell
carcinoma (ung thư thận) và urothelial cancer (ung
thư bàng quang hay đường tiết niệu).
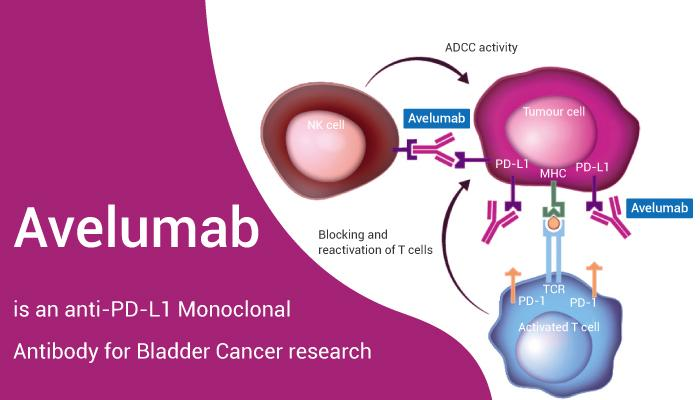
Hình: Avelumab
* Durvalumab (MEDI4736, Imfinzi@), thuốc
chuyên biệt hơn, kết bám có ái lực cao và
chuyên biệt vào PD-L1, do đó ức chế các
tương tác giữa PD-1 và CD80, được FDA xem
như một ‘đột phá’ về trị liệu ung thư ống
mật (chuẩn thuận tháng 2-2016). Durvalumab
cũng là một monoclonal antibody. Thuốc dùng
tiêm truyền mỗi 2-4 tuần trong thời gian 12
tháng.
Chi phí cho một đợt trị liệu khoảng
228,778 USD. https://www.ncbi.nlm.nih.gov/books/NBK599379/table/t03/
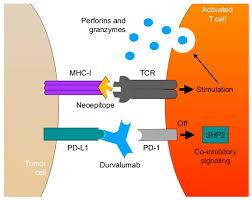
Hình và Cơ chế hoạt động của
Durvalumab
C-
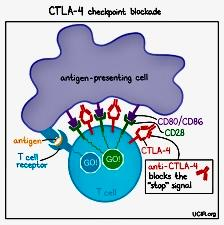
Thuốc ức chế CTLA-4 CTLA-4 là
một protein có trên màng tế bào T-cell,
protein này giúp hệ miễn nhiễm phản ứng
chống lại sự xâm nhập của các vật thể lạ
và kiểm soát các thay đổi có hại xảy ra
ở tế bào. Tuy nhiên, khi CTLA-4 kết bám
với các protein như B7-1 và B7-2, sẽ tạo
sự ‘ngăn cản = block’ các T-cell làm
nhiệm vụ nhận ra và tiêu diệt các tế bào
ung thư.
Những thuốc Ức chế CTLA-4 gắn
vào và chặn Cytotoxic
T-lymphocyte-associated protein 4
(CTLA-4), một protein điều hành chống
(negative regulator) lại việc khởi động
T-cell. Tác động này giúp cơ thể chống
ung thư. Chặn CTLA-4 cho phép khởi động
nhiều T-cell clones, sinh sôi và giảm ức
chế miễn nhiễm (immunosuppression).Thuốc
ức chế CTLA-4 hiện nay:
* Ipilimumab
(MDCX-010),Yervoy@, Bristol-Myers
Squibb), loại kháng thể
monoclonal, IgG1 mAb. Được FDA chấp
thuận (2011) dùng trị melanoma ở giai
đoạn di căn. Dùng chích tĩnh mạch mỗi 3
tuần, thời gian chích có thể kéo dài đến
90 phút cho một lần điều trị. Chi phí
điều trị, theo liều trung bình 820mg là
120 ngàn USD; Phương thức trị liệu toàn
bộ gồm 3 liều khởi đầu và sau đó mỗi 3
tháng, kéo dài trong 3 năm..Tổng chi phí
lên đến 1.77 triệu cho mỗi bệnh nhân. https://www.cancer.gov/about-cancer/treatment/drugs/ipilimumab
Hình: Yervoy và Cơ chế hoạt
động
* Tremelimimab
(Imjudo@, AstraZeneca) cũng
là monoclonal antibody mới được
chuẩn thuận (2-1022), hiện còn sử
dụng tương đối giới hạn trong các
trường hợp hepatocellular carcinoma
và non-small cell lung cancer.
Thuốc ức chế
CTLA-4 thường được dùng phối hợp
cùng một thuốc khác trong nhóm ICIs
loại ức chế PD-1 hay ức chế PD-L1.

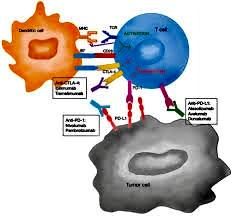
Hình: Tổng hợp Cơ chế hoạt động của các ICIs
(theo Cancer Therapy).
* Những
phản ứng phụ và hy vọng ..
Các thuốc
ICIs đã được xem là những khám phá mới, tiến
bộ vượt mức trong lĩnh vực điều trị ung thư,
đem lại hy vọng cho các bệnh nhân ung thư ở
vào giai đoạn cuối, khi tế bào ung thư bội
sinh và di căn..Tuy ICIs thật sự có những
kết quả tích cực nhưng chưa phải là toàn hảo,
thuốc vẫn gây nhiều phản ứng phụ, không thể
đoán trước và hiệu quả thay đổi.
* tùy từng
bệnh nhân, tùy tình trạng sức khỏe của bệnh
nhân trước khi được điều trị bằng thuốc ICIs.
* Tùy theo
loại thuốc ICI được dùng; tùy liều lượng của
mỗi loại ICIs.
* tùy theo sự
phối hợp các loại ICIs dùng trong điều trị.
Một số
phản ứng phụ thường xảy ta như:
* Da mẩn đỏ và
ngứa, nơi sau cổ và ở các đầu ngón tay-chân;
Màu da thay đổi.
* Tiêu chảy,
táo bón và đau bụng dưới. Phản ứng tiêu chảy
không xảy ra ngay khi trị liệu lần đầu nhưng
thường bắt đầu vài tuần sau khi được điều
trị và có thể có máu trong phân lỏng.
* Ho, tức ngực,
khó thở.
* Sưng gan, ít
xảy ra hơn. Phản ứng xảy ra sau khi trị liệu
khoảng 8-12 tuần, có thể kèm sốt, mệt và
vàng da.
* Rối loạn về
nội tiết, thường có thể là sưng tuyến yên
(pituitary) và tuyến giáp trạng (thyroid)
giảm hoạt động.
* Sưng xương
khớp, đau dây thần kinh.. (hiếm hơn).
Một số bộ
phận trong cơ thể, cũng có thể bị ảnh hưởng
do dùng thuốc ICIs như Phổi (sưng phổi, gây
ho, tức ngực); Mắt (sưng, đỏ mắt, gây sợ ánh
sáng, hình ảnh bị mờ); Tim (tức ngực, hụt
hơi, hồi hộp..).
Những
bệnh nhân đang có autoimmune disorders,
không thể chữa trị bằng ICIs… Hy
vọng? (theo Nature Communications; 2020(11).
Cách
đây 10 năm, trước khi các ICIs được FDA lần
lượt chuẩn thuận, việc điều trị các khối u
cứng bằng immunotherapy được xem là bị bế
tắc, khi chỉ dựa vào các immuno cytokines
như interleukin-2 và alpha-interferon, không
mấy hiệu quả và còn có độc tính cao..
Từ
2018, sau khi các ICIs chính thức được sử
dụng, cùng các kết quả rất phấn khởi, Cancer
immunotherapy đi vào một giai đoạn mới (Giải
Nobel Về Y học 2018 được trao tặng cho 2 nhà
miễn dịch học James Allison và Tasuku Honjo
là những người đã đưa ra các khái niệm căn
bản cho điều trị bằng ICI).
“..Một
trong những thành quả tạo ấn tượng nhất của
các thuốc ICIs là tạo được sự hồi phục (lành
bệnh) kéo dài sau khi ngưng điều trị, đem
đến hy vọng trị khỏi hẳn được ung thư nơi
một số bệnh nhân.
Rất nhiều trường hợp các bệnh nhân bị ung
thư ác tính melanoma đã được xác minh là
hoàn toàn không còn các hiện tượng di căn
(metastases). Trường hợp này có thể xảy ra
cho khoảng 20% bệnh nhân melanoma được điều
trị bằng các thuốc ức chế PD-1, dùng đơn độc
hay dùng phối hợp với một thuốc ức chế
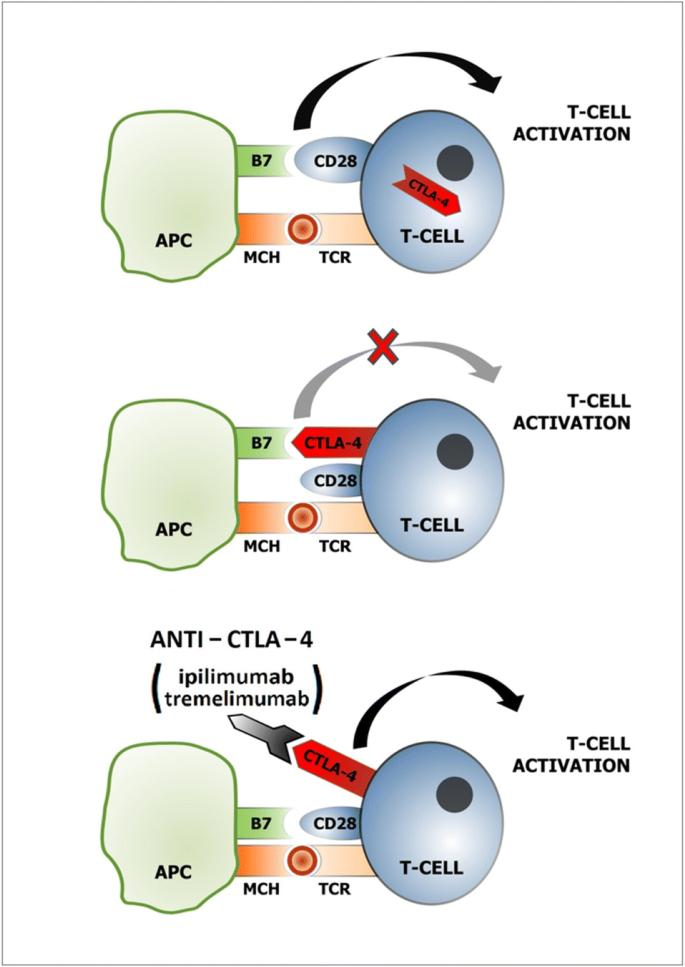
Cơ chế CTLA-4
Quan
niệm hiện được chấp nhận rộng rãi, là việc
điều trị cho các bệnh nhân, có thể tạm ngưng
sau ít nhất 6 tháng được điều trị, vì nguy
cơ bị tái phát (relapses) xuống được dưới
10% (tiếp tục được theo dõi trong 5 năm sau
khi ngưng trị liệu..).
Sự
kiện lành bệnh (remission) hoàn toàn kéo dài
này, là không thể tưởng tượng được trước
‘thời đại’ có các ICIs.
Tuy hiện nay, đáp ứng tích cực với ICIs chỉ
giới hạn trong việc trị liệu các ung thư
melanoma, sự hữu hiệu với các loại ung thư
khác chưa có đủ dữ kiện để chứng minh. Ngay
trong lĩnh vực melanoma là lĩnh vực có nhiều
triển vọng nhất: Trong thời gian một năm trị
bằng thuốc ức ché PD-1, có thêm các phương
thức bổ trợ (adjuvant therapies) cho thấy có
khả năng giúp giảm nguy cơ bị bệnh trở lại
(relapse); khi kèm thêm giải phẫu loại bỏ
các hạch bạch huyết (lymph nodes) di căn.
Với các loại ung thư khác như ung thư phổi,
thuốc ICIs hiện cũng đang được nghiên cứu
như một thành phần trong trị liệu bổ trợ
(adjuvant therapies). Một thay đổi quan
trọng khác về cách nhìn cho các BS và bệnh
nhân, có lẽ phát xuất từ hiện tượng là các
phản ứng phụ, xảy ra không giống nhau, nơi
các bệnh nhân ung thư ở vào giai đoạn di căn
và nơi các bệnh nhân được trị kèm adjuvant
therapies để tránh nguy cơ bị tái phát.. Ví
dụ như trong trường hợp hypothyroidism (xem
phần phản ứng phụ trên), có thể xảy ra nơi
10% bệnh nhân được trị liệu bằng thuốc ức
chế PD-1, (được xem là có thể ‘chấp nhận’
chuyên môn, trong trường hợp bệnh nhân đang
ở vào tình trạng ung thư di căn? Nhưng trong
trường hợp adjuvant therapies nguy cơ 10%
này vẫn đưa đến việc cần thẩm định, đánh giá
là rất có thể sẽ phải kèm thêm trị liệu về
các mất quân bình kích thích tố đến cuối đời?
Niềm hy vọng cao nhất hiện nay là có thêm
được những nghiên cứu khám phá mới về các
biomarkers, giúp theo dõi tiến triển của
bệnh, đồng thời giúp chọn được các ICIs tối
ưu và giảm được các phản ứng độc hại không
mong muốn! BS Scott Strome: Khoa
trưởng Trường Y Khoa của ĐH University of
Tennessee Health Science đã trị nhiều bệnh
nhân melanoma bằng ICIs nhận định:
* Khác với trị
liệu diệt tế bào ung thư bằng hóa chất
(chemotherapy), trị liệu miễn nhiễm ít độc
hơn nhiều và nhắm trực tiếp vào tế bào ung
thư.
* Phản ứng phụ
ít nguy hại hơn.
*
Immunotherapy rất tốn phí, và
khó có thể sử dụng phổ biến được!
* Kết quả
không thể đoán trước! và chưa có những hiểu
biết về các tác động phụ lâu dài! Phản ứng
phụ khi đã xảy ra lại không thể biến đổi
ngược lại được?
Trần Minh Quân
11-2024.
|
![]()