Những điểm cần khắc phục của máu tự nhiên (người)
Máu nhân tạo, còn được gọi dưới những tên Chất thay thế máu = blood substitute; surrogate blood..Tên gọi cho những chất được dùng để làm giống hệt = mimic và thay thế được phần nào các nhiệm vụ của máu sinh học tự nhiên..
Bài viết xin gửi tặng những thân hữu, tốt nghiệp tại Việt Nam, đến định cư trên đất Mỹ, làm việc trong ngành Medical Technology (chuyên về thí nghiệm). Riêng Blood Services tại Các Bệnh Viện và tại Hồng Thập Tự Mỹ lại là một ngành riêng. Khoa Hematology tuy có dạy về máu nhưng cũng không chuyên về Truyền máu (Blood transfusion). Trường Dược VNCH, những năm 1960s có môn Hematologie do GS Thái Tường phụ trách, nhưng việc thực tập rất giới hạn: Sinh viên được học phân loại Nhóm máu, dùng ‘lame’ và nhìn phản ứng kết tụ qua kính hiển vi.. Quân Y Quân lực VNCH có Trung Tâm Tiếp Huyết.. Các quân dược sĩ thường phụ trách các Phòng ‘Truyền máu’ tại các Quân Y viện, BV Phối Hợp Dân quân Y …
Tại Hoa Kỳ, các Dược Sĩ không học về.. thử nghiệm và truyền máu..
Muốn trở thành một Chuyên viên Ngân Hàng Máu (SBB = Specialist in Blood Banking) cần phải có BS về biology/chemistry, thêm 1-2 năm học chuyên nghiệp (tùy Trường đào tạo) hay học thêm lên cấp Master in Blood Bank Technology và sau đó thêm 1 năm thực tập. Phải qua một kỳ thi Board of Certification (BOC), SBB phải được ‘chứng nhận’ bởi Commission on Accredited of Allied Health Education Programs (CAAHEP).
Một SBB được xếp vào hạng GS-11 trong thang cấp lương của Federal Pay. Tùy theo khả năng và kinh nghiệm, cũng như chức vụ đã nhiệm tại các Trung Tâm Blood Services, lương bỗng của SBB trung bình khoảng 85,000 USD/năm, có thể trên 126,000 USD và với nhiệm vụ lãnh đạo có thể 240,000 USD tùy mức độ quan trọng của Trung Tâm và của BV.
Sau hơn 400 năm nghiên cứu, các nhà khoa học đã tiến gần đến mục tiêu phát triển được một Chất chuyển vận oxygen nhân tạo, khả thi (viable); có thể dùng cho các bệnh nhân bị tai nạn đe dọa đến tính mạng (trauma) ngay tại chỗ..
Cultured red blood cells: a window into the future of transfusions and therapeutics | Research |
(Tế bào hồng cầu nuôi cấy: Cánh cửa mở ra tương lai của truyền máu và liệu pháp điều trị | Nghiên cứu |)
Cuộc Tìm kiếm một chế phẩm máu nhân tạo: The quest to create an artificial blood product.
Những cột mốc thời gian (trước 2000), trong công cuộc tìm kiếm cách thay thế Máu:
– 1667: Cuộc truyền máu đầu tiên được thực hiện, nhưng sau đó việc truyền máu bị ngừng lại, sau khi có những trường hợp bệnh nhân nhận máu bị tử vong.
– 1854: Các Y-Bác Sĩ tìm cách thay thế máu bằng sữa; chích sữa cho bệnh nhân bị dịch tả, hy vọng máu sẽ được tái tạo.(BS Theodore Thomas dùng sữa truyền dịch tại BV Phụ khoa, New York City-(1875).
–1868: Các nhà nghiên cứu tìm thấy dung dịch chứa hemoglobin, cô lập có thể dùng để thay thế máu.
– 1871: Plasma (huyết tương) và máu thú vật được thử nghiệm để thay thế cho máu người.
– 1883: Dung dịch Ringer, một hỗn hợp các muối calcium, potassium và sodium được tìm ra. Dung dịch được cho thấy là giữ được tim ếch, lấy ra khỏi cơ thể, tiếp tục đập; và sau đó dung dịch được dùng cho người sau khi được thêm lactate. Dung dịch hiện nay này vẫn còn được dùng như một chất làm tăng thể tích máu (blood volume expander).
– 1930: BS Karl Landsteiner, đoạt giải Nobel Về Sinh học và Y khoa-1930, do các khám phá của ông về phân loại máu thành các nhóm A, B, O và AB; Khám phá và phân loại này đã đặt ra việc phải xác định nhóm máu trước khi được truyền máu..
– 1934: Chế tạo được một hemoglobin chuyên chở oxygen (đầu tiên), gốc từ hồng cầu của bò. GS William Ruthrouff Anderson đã dùng để trị bệnh cho mèo.
– 1947: Hồng thập Tư Mỹ thiết lập các Ngân Hàng Máu sau khi các nhà khoa học xác định được là plasma do người hiến tặng đã ngừa được các binh sĩ bị thương đi vào sốc, do mất máu trong Thế chiến 2.
– 1949: GS Amberson công bố một kết quả nghiên cứu mô tả việc sử dụng một dung dịch điều trị không chứa hemoglobin, thử nghiệm nơi người.
– 1966: Các nhà nghiên cứu thử nghiệm, lần đầu tiên dùng perfluorochemicals để thay thế máu, nơi chuột..
– 1986: Các nghiên cứu biết được bệnh nhiễm HIV và bệnh Sưng gan do Siêu vi, có thể lây lan, do truyền máu, tạo trở lại một nhu cầu cần tìm máu nhân tạo..
Năm 2023, Cơ quan Defense Advanced Research Project (DARPA) công bố đã tặng thưởng 46.4 triệu USD từ Trợ cấp Liên bang cho BS Allan Doctor và các Cộng sự viên (ĐH Y khoa Maryland) để tiếp tục tìm cách phát triển chế tạo một thành phẩm máu toàn vẹn, sinh học, có thể sử dụng tại chiến trường..
5 Innovative Artificial Blood Substitute Companies in the World | Trends
1- Nhu cầu cần có Máu nhân tạo:
Máu nhân tạo, không chỉ là một dụng cụ trong các việc chăm sóc các bệnh nhân chưa kịp được nhập viện điều trị (preclinical settings), ngay tại chỗ gặp tai nạn hay nơi chiến trường, nhưng còn có thể giúp làm giảm khan hiếm máu tại Mỹ và tại các nơi khác trên thế giới.
BS Brie Stotler MD, MPH (Giám đốc Khoa Truyền máu tại Trung Tâm Y khoa Irving và Bệnh viện Presbyterian, New York) cho biết: Số cung về máu tại Mỹ đang ở vào tình trạng báo động. Các lý do được giải thích là:
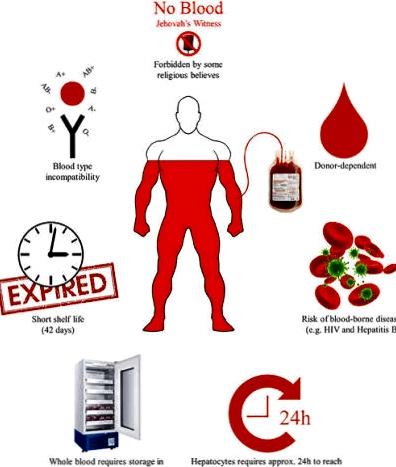
* Máu hiến tặng phải được sử dụng trong một thời gian rất ngắn:
– Tiểu cầu (platelets) trong vòng 5 đến 7 ngày.
– RBC (Red Blood Cells) phải sử dụng trong vòng 42 ngày sau khi được hiến..
Do đó luôn luôn có nhu cầu hiến máu, gần như mỗi ngày!
Hồng Thập Tự Mỹ, cung cấp được 40% nhu cầu Máu và các chế phẩm từ Máu, ước lượng lên đến 29 nghìn đơn vị RBC tại Mỹ; trong khi đó chỉ có khoảng 3% dân số Mỹ được xem là ‘có đủ tiêu chuẩn’ để hiến máu..
National Blood Services Etablissement francais, báo động: Pháp luôn thiếu máu; việc hiến máu mỗi ngày không đủ cung ứng cho nhu cầu 10 ngàn đơn vị RBC/ngày, và vấn đề có được nhóm máu thích hợp còn gây thêm tình trạng thiếu loại máu O (-).
Nhu cầu về Máu còn gia tăng khi xét đến vấn đề nhóm máu:
* Nhóm máu O (Rh-) được xem là nhóm máu duy nhất, có thể truyền cho tất cả mọi người; Chỉ 7% dân số Mỹ có nhóm máu này!
Sự khan hiếm máu này còn thảm hơn trên thế giới: mỗi năm các quốc gia được xếp vào hạng có thu nhập thấp và thu nhập trung bình, trên thế giới bị thiếu đến trên 100 triệu đơn vị máu. Tại các khu vực này, tình trạng thiếu máu luôn trầm trọng.. và không có những cơ sở y-tế an toàn để có thể truyền máu.. Các khu vực này được gọi là blood déserts; chưa kể đến vấn đề tín ngưỡng, có những tôn giáo (như Giáo phái Jehovah Witness) không chấp nhận việc truyền máu, người cho người..
Về Nhóm máu, Hồng thập Tự Mỹ, xin mời đọc:
“Thời sự khoa học: Nhóm máu mới, Hồng thập tự Mỹ và Dịch vụ về Máu”.
Making artificial blood for transfusions (Sản xuất máu nhân tạo để truyền máu).
2- Ý tưởng về Máu nhân tạo:
Ý tưởng về nhu cầu cần có Máu nhân tạo được đặt ra từ lâu, nhưng việc thực hiện lại thật khó khăn phức tạp vì nhiều tiêu chuẩn được đặt ra: Theo BS Stotler: máu nhân tạo lý tưởng phải là:
* Không gây phản ứng miễn dịch (non immunogenic), nghĩa là không gây phản ứng của hệ miễn nhiễm khi được đưa vào cơ thể người nhận.
* Giữ được vai trò mang oxygen từ phổi, đến trao lại cho các mô tế bào hoạt động trong cơ thể..
* Ở lại được trong hệ thống tuần hoàn bên trong cơ thể người nhận, một thời gian đủ lâu, để cơ thể người nhận có thể tái tạo được máu của chính mình.
“Khi hồng huyết cầu của một người bị sụt giảm xuống đến một mức quan trọng/thiết yếu (crucial), có thể gây tử vong.. thì việc đưa vào cơ thể người này ‘một chất gì đó’, cần phải được liên tục trong ít nhất là 5, 6 đến 7 ngày..”
* Lịch sử của Artificial Oxygen Carriers (AOC’s)
Công cuộc đi tìm một ‘chất’ thay thế được cho máu người, không phải là cuộc phiêu lưu ngẫu hứng, nhưng đã được nhân loại đi tìm từ những năm đầu của 1600s.
Qua bao năm, các Y Sĩ đầu tiên trên thế giới đã thử dùng sữa, nước tiểu, bia, máu và plasma động vật, nước muối,.. để ‘bắt chước’ các nhiệm vụ của máu trong cơ thể.. nhưng không đạt được kết quả như mong muốn!
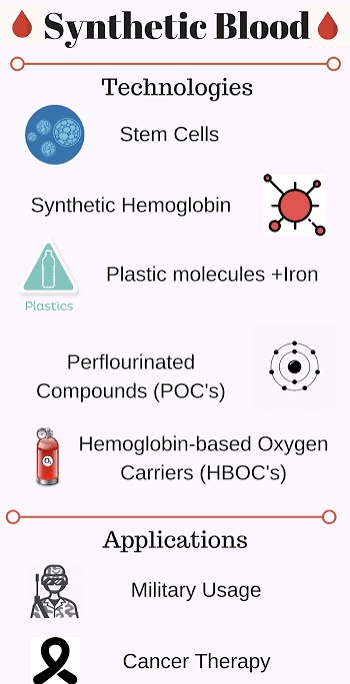
Các chất, tổng hợp hay biến đổi, để thay thế được máu, chia thành 2 nhóm:
* Nhóm perfluorocarbons (PFCs).
* Nhóm vận chuyển oxygen dựa căn bản trên hemoglobin (hemoglobin-based oxygen carriers (HBOCs).
A- PCFs:PCF được định nghĩa như là ‘một phân tử tổng hợp gồm các nguyên tử cacbon và fluorine mang oxygen, được khám phá và sử dụng từ 1960s. PCF có thể hòa tan lượng oxygen cao gấp 50 lần lượng oxy trong huyết tương, nhưng cần phải ở dạng nhũ dịch (emulsified). Các thử nghiệm sơ khởi, sử dụng đầu tiên, gây độc hại cho các mô tế bào nên không thể tiếp tục. Các nghiên cứu hy vọng rằng các tiến bộ sinh học mới, vẫn có thể cho phép tái sử dụng PCFs ?
B- HBOCs:
HBOC mặt khác, dựa trên hemoglobin, phương thức tự nhiên của cơ thể trong việc chuyển vận oxygen đi khắp cơ thể.
Vấn đề được đặt ra là một khi ra khỏi RBC, hemoglobin trở thành chất độc, dẫn đến gia tăng áp huyết nơi bệnh nhân, gây hư hại thận và các bộ phận khác..
Đã có những thử nghiệm trên người trong những năm 2000s, dùng những hợp chất khác nhau trong nhóm, nhưng tất cả đều gây tử vong và trụy tim khi thử nghiệm ‘nhóm hợp chất thay thế máu’ thuộc thế hệ đầu tiên này’..
* Trị liệu cho bệnh nhân bằng HBOCs:
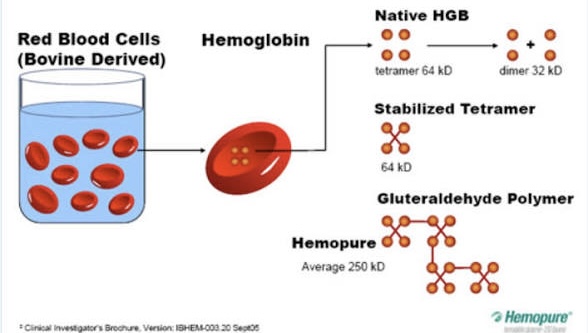
Cho tới hiện nay, thành phẩm loại HBOC thành công nhất khi đưa ra thử nghiệm là Hemopure, một chất tổng hợp, bằng ly tách hemoglobin từ RBCs của bò. Hemoglobin này sau đó được tinh khiết hóa, và dùng kỹ thuật hóa học để kết nối (bonded) với các protein để tạo ra một tetramer..
BS Jonathan Waters, GS môn ’Anesthesiology & Bioengineering’ tại ĐH Pittsburgh Medical Center, đã dùng HBOC ( trong đó có HemoPure và Sanguinate = một loại HBOC khác không còn sản xuất), trong nhiều năm để điều trị cho khoảng 1600 bệnh nhân mỗi năm, thuộc Giáo phái Jehovah’s Witnesses (không chấp nhận truyền máu từ người khác, dù là đồng đạo), Trong số bệnh nhân đó, có nhiều người nhận HemoPure..
Hemopure không được FDA chuẩn thuận, nhưng BS Walters đã được phép dùng Chế phẩm này dựa theo Chương trình Investigational Drug Approval, FDA tạm cho phép dùng khi không còn thuốc nào thay thế! Ông cho rằng đây là một ‘cây cầu’ giúp Bệnh nhân, kéo dài thêm được thời gian sinh tồn, hy vọng tủy sống của mình có thể sản xuất ra máu.. kịp thời!
Cũng như các thành phẩm tiền phong như PolyHeme, HemAssist và Hemospan.. thành phẩm HemoPure cũng có nguy cơ bị ngưng sản xuất; sau khi một nghiên cứu (meta-analysis) 2008, tìm thấy là HBOCs có liên hệ đến một số trường hợp tử vong và gây nhồi máu cơ tim (myocardial infarction).
3- Các nghiên cứu mới..
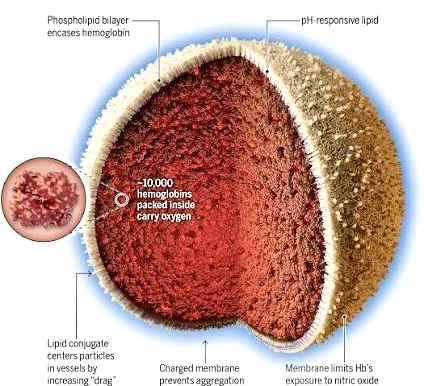
Những nhà nghiên cứu hiện nay hy vọng là các HBOCs thế hệ mới, có thể vượt qua được những khiếm khuyết của các HBOC tiên phong? Nhóm chuyên viên Dipanjan Pan (Ph.D, MSc), GS về Nanomedicine tại ĐH Penn State và BS Philip Spinella MD, ĐH Pittsburgh đã thành lập Công ty Kalocyte (2016) và sáng chế được Erythromer, một HMOCs thuộc thế hệ mới..
Erythromer có những đặc điểm mới khác biệt, vì tìm được phương thức ngăn cản độc tính của hemoglobin tự do, khi vào cơ thể, bằng cách ‘bọc = encapsulate) hemoglobin cùng những phân tử nhỏ khác, bằng một màng bao nhân tạo đặc biệt, tác động như một vỏ bọc kín (shell).
Vỏ bọc ngoài này được mã hóa để điều hành khả năng ‘thu hút’ oxygen của hemoglobin, tăng tiềm năng chuyển vận oxy, và tính theo trọng lượng thì hemoglobin (trong bọc) còn mang lượng oxy nhiều hơn, gấp từ 2 đến 3 lần so với oxygen trữ trong các RBC.
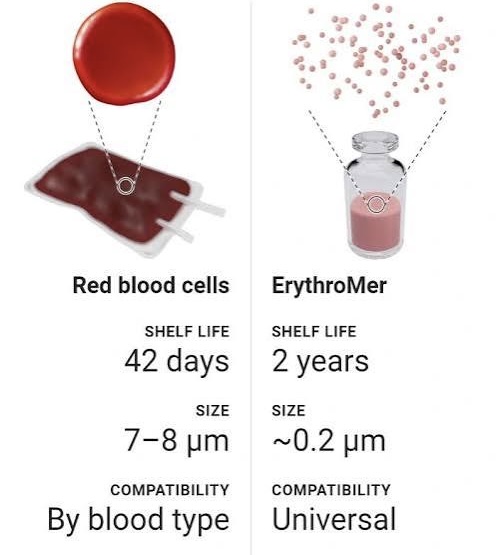
Erythromer có thể tồn trữ, giữ nguyên hoạt tính ít nhất là một năm, ở dạng bột khô màu đỏ, nhẹ và dễ chuyên chở hơn máu (người). Binh sĩ có thể mang theo trong túi lưng; và thành phẩm dùng được, trực tiếp trên các xe cứu thương. Khi cần chỉ pha nước và sau 1-2 phút có thể dùng truyền dịch..
Erythromer cho những kết quả rất khích lệ, khi thử trên thú vật (thỏ) nhưng vẫn còn ở trong giai đoạn thử nghiệm lâm sàng trên người..
Cho đến tháng Giêng 2025, Erythomer vẫn còn là một ‘thuốc thử nghiệm’.. và hy vọng sẽ có thể giúp giảm được nhu cầu máu ‘tươi’ cần người hiến tặng?
Với sự đầu tư 48 triệu USD của Quân đội Mỹ; Erythromer là ‘ứng viên’.. dẫn đầu cuộc đua..
Xin đọc thêm tại:
https://www.science.org/content/article/ultimate-blood-substitute-us-military-betting-46-millionDù cho được FDA chuẩn thuận, việc sử dụng Erythromer vẫn còn có những vấn đề y học cần giải quyết như:
* Xác định liều lượng.
* Chọn bệnh nhân thích hợp để tiếp nhận ‘máu nhân tạo’.
* Và tỷ lệ các chất cần phải thêm vào Erythromer như plasma và platelets đông khô.
Công ty Kalocyte còn những kế hoạch phụ thuộc như:
* Thử nghiệm tạo RBC từ Erythromer.
* Làm đông khô (freeze-dried plasma and platelets) để có thể vận chuyển gọn gàng và tồn trữ được lâu hơn.
A- Chế tạo từng thành phần của Máu: Sciences & Avenir (7-19-25):
Máu nhân tạo là mục tiêu còn quá xa, nên một số nhà nghiên cứu đã thử nghiệm chế tạo từng thành phần của máu, tùy theo nhiệm vụ của mỗi thành phần.
Các nhóm nghiên cứu Âu châu: Pháp (Hôpital St Antoine Paris) và Anh (Université de Cambridge), đã chế tạo được từ 2011, bằng các phương pháp nhân tạo, các hồng cầu (globules rouges=RBC) và các tiểu cầu (plaquettes) từ:
* Các tế bào gốc tạo máu (‘hematopoietic’ primaire), gọi là CD34+
* Các tế bào gốc (cellules souche) cảm ứng đa năng (pluripotentes induites (iPSC).
Vài phương thức chế tạo các phần tử của Máu từ Tế bào gốc (Stem cells)::
Các thử nghiệm dùng các thành phẩm chế tạo được từ stem cells đã được thử nghiệm tại Pháp (2011) do nhóm các BS và Chuyên viên tại Université Pierre et Marie Curie ở Paris.
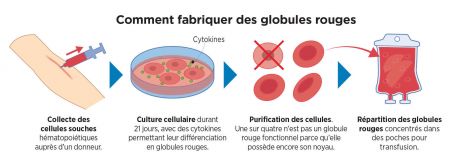
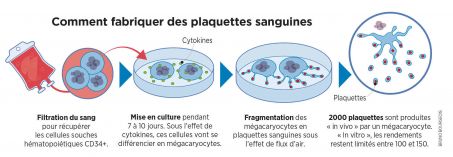
a- Nuôi cấy hồng cầu:
(1)- Thu nhặt các tế bào gốc tạo máu, từ máu người hiến tặng;
(2)- Cấy mô trong 21 ngày cùng các Cytokines để phân lập các phần trong hồng cầu;
(3) Tinh khiết hóa các tế bào: 1 trong 4 tế bào không được xem là hồng cầu có hoạt tính, vì không có nhân, sẽ bị loại bỏ;
(4) Phân phối các hồng cầu cô đặc trong các bịch để truyền.
b-Chế tạo platelet
(1) – Lọc máu để lấy các tế bào gốc tạo máu CD34+;
(2) – Nuôi cấy trong từ 7 đến 10 ngày, dưới tác động của các cytokines, các tế bào nuôi cấy sẽ tự phân lập thành các megacaryocytes;
(3) – Phân đoạn các megacaryocytes thành tiểu cầu dưới tác động của các luồng không khi;
(4) – Mỗi megacaryocytes có thể sản xuất được 2000 tiểu cầu (in vitro).
B- Phát minh từ Nhật: hy vọng hay.. mừng hụt?
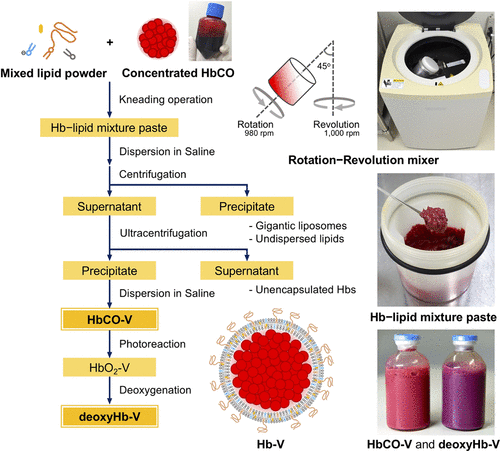
Theo thông báo ngày 10 tháng 6-2025, các nhà nghiên cứu Nhật tại ĐH Nara (Nhật) đã chế tạo được ‘hemoglobin vesicles (HbVs) (Hemoglobin được bọc trong một vỏ bằng phospholipid (liposomal membrane), có thể ‘nhái’ = mimic được RBC.. (Năm 2022, 100ml thành phẩm này đã được chích cho 12 người khỏe mạnh, mà không có những phản ứng phụ nào đáng kể).
Tiến trình tạo HvB phải qua nhiều giai đoạn từ (1): Cô đặc hồng cầu trong máu, rửa bằng nước muối, ly trích và lấy tế bào erythrocyte; carbonyl hóa; khử trùng; lọc loại độc chất; lọc nanofiltration loại virus; điều chỉnh các thông số sinh học để có HbCO tinh khiết.. (2) Bọc bằng lipids bột; loại những tế bào Hb không bao; khử carbonyl; và khử oxy (3) thành phẩm ‘deoxygenated HbV’ trong chai.
(Lipid trong lớp bọc gồm : DPPC; Cholesterol; DHSG và DSPE-PEG).
Về liposomal membrane dùng trong HbV, xin đọc chi tiết tại: https://pmc.ncbi.nlm.gov/articles/PMC9816666/
Nhóm nghiên cứu dự trù sẽ chích lượng cao hơn, đến 400ml, thử nghiệm trong nhóm dân số đông hơn, đồng thời theo dõi thêm các tác động huyết học và độc tính.. Nếu thử nghiệm tiến hành tốt đẹp, HbVs có thể đưa ra sử dụng lâm sàng vào 2030.
* Nhóm nghiên cứu Nara, do BS Hiromi Sakai hướng dẫn, ly trích hemoglobin từ máu hiến tặng, mãn hạn sử dụng; sau đó bọc các hemoglobin này bằng một vỏ bảo vệ, để tạo được các tế bào máu mới, không cần thử nghiệm về nhóm máu.
* Bên cạnh các nghiên cứu của nhóm Sakai, một nhóm nghiên cứu Nhật khác do GS Teruyuku Komatsu tại ĐH Chuo cũng đang tìm cách triển khai một hợp chất chuyển vận oxygen dùng hemoglobin, bọc trong một vỏ gồm các protein trong gia đình albumin để ổn định huyết áp và trị các trường hợp xuất huyết, stroke..
C- Khác biệt giữa Hemoglobin Vesicles (HbV) từ Nhật và Erythromer?
* Về mục tiêu: cả hai được thiết kế với mục tiêu là thay thế máu để chuyển vận oxygen.
* Về phương diện sinh hoá, cả hai thành phẩm đều được sản xuất theo nguyên tắc: Bọc (encapsulated) hemoglobin bằng một lớp vỏ, giữ được khả năng chuyển vận oxygen, đồng thời khi bọc sẽ ngăn được tác động gây độc hại của hemoglobin khi bị lấy ra khỏi Red blood cell (RBC), và loại được các yếu tố miễn nhiễm buộc phải phân loại máu thành từng nhóm.
(Erythromer có thể xem là một HbV chuyên biệt..)
* Erythromer được sáng chế tại Mỹ dựa theo nguyên tắc căn bản của HvB Nhật:
Erythromer là thành phẩm thay thế máu, dùng hemoglobin người bọc trong một vỏ bọc ổn định như một lớp màng bảo vệ; phóng thích oxygen cùng với các phân tử nhỏ kèm theo, tác dụng ngăn cản không để hemoglobin bị oxy-hóa và điều khiển được ái lực với oxy.
* HbVs có cơ cấu liposome, bọc kín hemoglobin, không để thoát ra, giữ được hoạt tính ‘nhái theo’ RBC, tránh các vấn đề gây độc của hemoglobin tự do (gây co mạch) và tránh được sự cần thiết phải xác định Nhóm máu.
HvBs Nhật, dạng dịch treo = suspension, đựng trong bịch được dùng truyền trực tiếp còn Erythromer, là dạng nanoscale, đông khô, có thể tồn trữ lâu dài và sử dụng trong các trường hợp khẩn cấp ngay tại chỗ.
Các thành quả của nghiên cứu và kỹ thuật đầy hứa hẹn: Sẽ có những tiến bộ trong việc chế tạo được những thành phẩm thay thế máu (tuy hiện vẫn chỉ giới hạn trong vấn đề chuyển vận oxygen). Hy vọng dự trù đến 2030 sẽ có một chế phẩm.. an toàn và làm thêm được những nhiệm vụ của máu tự nhiên..
Tuy vẫn chỉ là hy vọng, nhưng có còn hơn không?
How close are we to a breakthrough in developing artificial blood?
(Chúng ta đã gần đạt được bước đột phá trong việc phát triển máu nhân tạo đến mức nào?)Trần Minh Quân 11-2025